瘦素是什么?这个基因可能会让你更胖
瘦素是一种激素,由你的脂肪细胞分泌,释放到血液中,它作为一种「信号」向你的脑「报告」身体脂肪的存储情况。
正常情况下,如果你的体重增加,脂肪变多,脂肪细胞产生的瘦素会更多,它「报告」给脑后,身体就会做出「减重」的反应,比如降低食欲或者提高代谢等。
总之,有了瘦素,它会帮助维持你的体重和体脂。所以如果两个人的体脂相同,但是一个人天生瘦素分泌更少,那他对体重的增长会更不敏感,体重可能会更高。
2019 年,发表在 Nature Medicine 期刊上的一篇研究发现 rs10487505 位点为 G 的人,相同体重指数下,瘦素水平可能会更高。即我们可以推测:
CC:瘦素水平可能较低,体重可能更高,食欲一般比较好,对食物更关注,身体对体重增加的调节能力更弱。
GC:瘦素水平可能较高,体形比较匀称,对食物的关注一般,身体对体重增加的调节能力较好。
GG:瘦素水平可能最高,体重可能较低,对食物的关注较少,身体对体重增加的调节能力最好。
一个故事,9 岁就 200 斤了
1999 年,英国剑桥大学研究肥胖的专家 Stephen O'rahilly,介绍了这样一个案例。
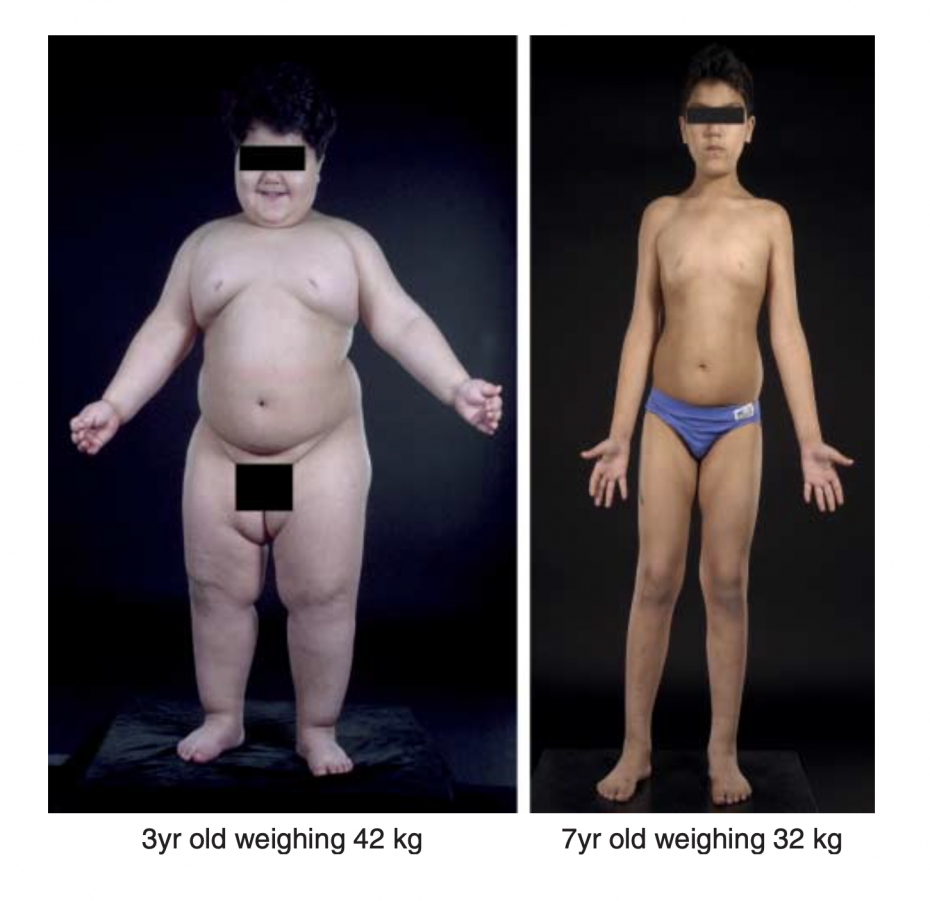
这个女孩只有 9 岁,体重却高达 94.4 公斤。由于严重肥胖,导致腿部外翻畸形,不得做手术来缓解。
其实她刚出生时并不胖,大概在 4 个月大的时候,体重就开始飙升,1 岁的时候就到了 15 公斤。
伴随体重激增,是她惊人的食欲。她好像一直都处于饥饿之中,热爱和食物有关的一切,且一旦得不到满足,就会发脾气,打人,很明显,她对食物上瘾了。
所以究竟发生了什么?迫使她一直在体验饥饿感,一直吃,哪怕已经胖到需要做轮椅。
肥胖专家进一步发现,这个小女孩来自一个巴基斯坦血统家庭,且父母是堂兄妹。这种近亲结合的情况,孩子有致病基因突变的可能性更高,这也许就是她过度肥胖的「罪魁祸首」。
不过在人体 30 亿多 DNA 字母中,找到那一个「错误」,就像大海捞针,何况还是在 1999 年,毕竟直到 2003 年人类基因组计划才完成,我们才第一次了解到人体 DNA 的全貌。
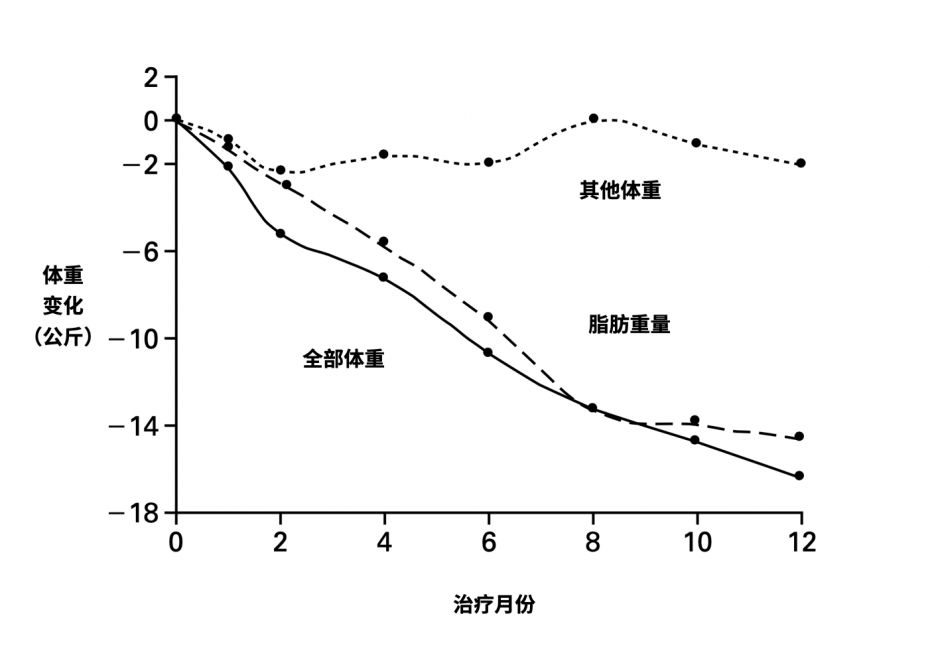
那这个孩子究竟有啥问题,只能靠目前有限的证据去猜测了。经过分析后,肥胖专家认为她很可能是缺乏一种激素,且开始每天上午 8 点给孩子注射这种激素,神奇的事情发生了,经过 12 个月的治疗,她的体重降低了 18 公斤,且减掉的几乎都是脂肪。
这个结果也证明了,小女孩身体里的确缺乏一种激素,这个激素有个非常吸引人的名字——瘦素。
这并非是上面的小女孩,也是一个天生缺乏瘦素的人,经过瘦素注射治疗后,体重回归正常,但是不知道为什么笑容怎么没有了呢?
瘦素是什么?
瘦素英文名为 Leptin,源于希腊语 λεπτός (leptos),瘦的意思,是一种蛋白类激素,于 1994 年正式发现。
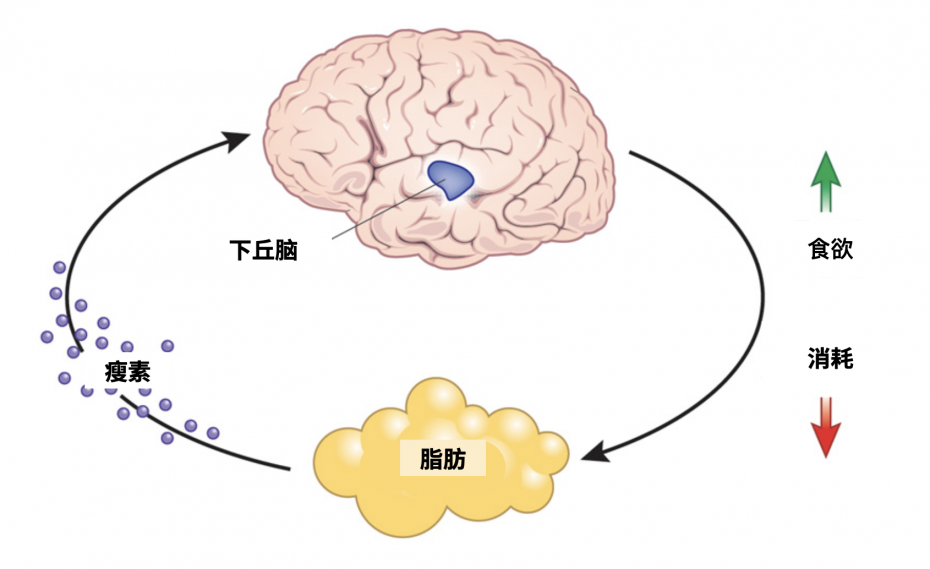
简单来说,瘦素是「脂肪细胞」和「脑」交流的「信号」。
瘦素是脂肪细胞分泌的,随着血液循环到达下丘脑,告知「下丘脑」身体的脂肪存储情况,下丘脑会根据实际情况做调整。
比如你这段时间吃得比较多,营养过剩,脂肪增多,那么正常情况下,你体内的瘦素也会增多。如果下丘脑 get 到瘦素增多,它就会让你「降低食欲」和「提高代谢」,从而起到控制「体脂」的作用。
相反,如果你这段时间为了减重,过度节食,脂肪减少,那相应的,你体内的瘦素就会降低。下丘脑了解到这种情况,为了抑制你的脂肪流失,它反而会让你提高食欲,降低身体代谢。所以极端节食往往之后会出现暴饮暴食。
就像开头提到的小女孩,她的脂肪细胞就没有能力分泌「瘦素」,所以尽管已经非常胖了,但是下丘脑不知道呀,它反而认为身体没有脂肪了,就要死掉了,所以赶紧自救,让小女孩一直不停地吃,每时每刻都想着食物。
当然这个小女孩的情况比较极端,在人群中也比较罕见,不过对于我们普通人来说,血液中瘦素的量,也有个人差异。
这个差异是受多个基因上的多个位点影响的。比如编码瘦素的基因,接收信号的瘦素受体基因等。
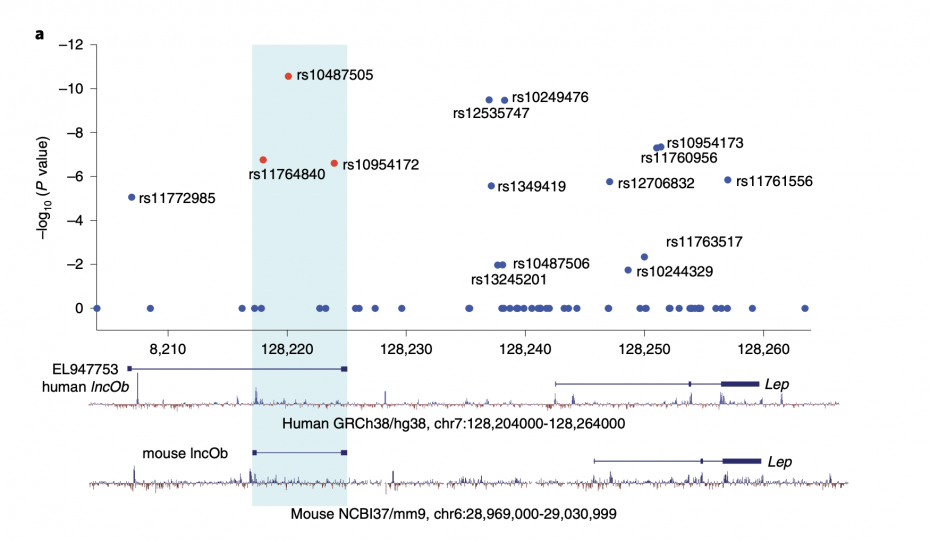
2019 年,发表在 Nature Medicine 期刊上的一篇研究发现一种长链非编码 RNA 也会调节瘦素的分泌。
结合 2015 年一项针对 3 万人的瘦素全基因组研究发现,基因位点 rs10487505 上有 G 的人,相同体重指数下,瘦素水平可能会更高,对体重增加的调节更快,从而体重跟低。
那减肥注射瘦素就行了吧?
看到这里,你可能会形成一个印象,如果我想减肥是不是向体内注射瘦素就可以了?不用节食,不用运动,轻轻松松躺瘦?
1994 年发现瘦素的科学家 Jeffrey M. Friedman,当时也是这么想的。
他在重磅论文发表的前一天就给瘦素申请的专利,且最后以 200 万美元的价格卖给了世界最大的制药公司之一,AMGen。
不过让大家失望的是,注射瘦素除了对于先天瘦素缺乏的人有效,比如开头的小女孩,对于普通的肥胖人群,减重效果并不好。效果好的人,可能还是缺乏瘦素,只是不像开头的小女孩这么严重。
并且检测人血液中的瘦素含量,体脂越高,含量越高,有些普通胖的人,体内的瘦素水平已经非常高了。
比如针对 1234 位中国成年人的检测发现,男性血液中的瘦素平均为 1.45 ng/ml,女性则为 8.32 ng/m,女性由于体脂比男性高,所以瘦素水平也会更高。
所以这究竟是为什么?
我们再来看下这张图:
脂肪增多,瘦素增多,但是下丘脑接收「瘦素」的能力却是有上线的,超过一定水平,它就对体内的脂肪视而不见,开始「装死」,自然也不会降低你的食欲,督促你提高代谢。
这样的现象叫瘦素抵抗。
听起来是不是很熟悉,2 型糖尿病的典型特征就是胰岛素抵抗。
基于此,发现瘦素的科学家 Jeffrey M. Friedman 在 2019 年的一篇综述提出,可以从理解糖尿病的角度来理解肥胖。
I 型糖尿病的典型表现是缺乏胰岛素,使用胰岛素治疗效果非常好;对应的就是 1 型肥胖,体内无法制造足够多的瘦素引发,注射瘦素治疗效果非常好;
2 型糖尿病的典型表现则是胰岛素抵抗,即体内胰岛素水平很高,但是无法起效;对应的就是 2 型肥胖,同样出现瘦素抵抗。
但是这 2 者有个很显著的差别是:2 型糖尿病,通过注射更多胰岛素,细胞还是能继续进行正常糖代谢,而所谓的 2 型肥胖,注射再多瘦素可能都没用。
可见脂肪作为能量储备实在太重要了,进化上有个分析视角,可能大家也比较熟悉了,就是节俭基因假说(thrifty-gene hypothesis)。我们之前的祖先总是饥一顿饱一顿,所以对高油高盐高脂的食物天生更偏好,生活在食物极度丰富的今天,肥胖和糖尿病就得上了。
但进化其实还有另外一个角度,捕食者假说(predator-release hypothesis),简单说就是储存能量固然重要,但是如果太胖了,奔跑速度肯定会变慢,更可能被当成食物抓到。
所以经过长久的进化积累,我们的身体其实兼顾上述两者,针对脂肪储存,有一套调节系统,只是从权重上看,似乎更偏「储存」能量:比如 2 型糖尿病,注射胰岛素,身体就可以让葡萄糖进入细胞,而多余的葡萄糖会转化成脂肪存储,脂肪多到一定程度,瘦素虽然多,却无法「叫醒」下丘脑,基本默认接受了脂肪的增加。
所以,到底怎么减?
像文章开头身体无法产生瘦素的人毕竟是罕见的,当然我们普通人也会在瘦素水平上存在差异。
了解瘦素,其实是想让大家意识到,你的身体是很复杂的系统,它有很多精妙的设计。脂肪细胞并非只是你厌恶的肥肉,它也一直在和身体的其他部分交流,针对它人体有一整套调节系统。
据我自己的观察,这套系统每个人其实并不一样,瘦素的量只是其中一个比较重要的部分。
有些人的系统调节能力很强,稍微控制下饮食和增加一点运动,体重就会降低,且身体并没有明显不适感;
但是有些人的系统调节能力比较弱,它调整起来特别慢,下降同样的体重,可能需要更多时间;
而有些人的系统甚至会抗拒改变,就想保持现在的体重,此时你如果开始节食,它就会给你制造暴食。
我们普通人大多是后面这 2 种类型。
说了这么多,其实就想告诉大家,减脂这件事不仅仅和所谓的「意志力」有关,脂肪在你身体的存储,很多都已经写在基因里了,身体有自己的运行规律,如果不了解和漠视这些规律,过度节食和运动,甚至服用药物,都是不可取的。
这些极端的手段,就是身体脂肪调节系统的「创伤」,必然会留下疤痕。
参考文献